近期,武汉病毒研究所周宁一研究员课题组在微生物龙胆酸代谢的多样性研究上取得进展:在低G+C含量的革兰氏阳性菌类芽胞杆菌中发现了一种新型的依赖于半胱氨酸的顺丁烯二酸单酰丙酮酸异构酶;在假单胞菌中发现了编码催化顺丁烯二酸单酰丙酮酸直接水解的酶基因。相关结果分别发表在微生物学重要刊物Journal of Bacteriology和Applied and Environmental Microbiology上。
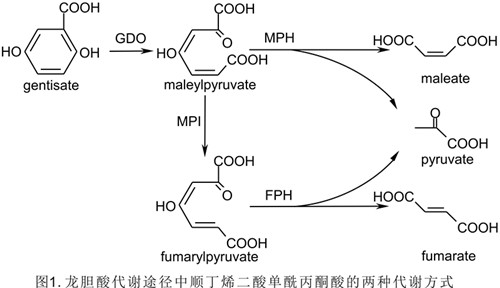
龙胆酸代谢途径是微生物降解芳烃化合物过程中一条重要的开环途径。龙胆酸在开环形成顺丁烯二酸单酰丙酮酸之后的代谢分为两种途径:一种是在依赖于巯基辅因子的异构酶作用后,再经水解作用进入三羧酸循环;另一种是直接水解进入三羧酸循环(图1)。目前已报道的异构酶有两种类型,在革兰氏阴性菌中依赖于谷胱甘肽;在高G+C含量的革兰氏阳性菌中依赖于分枝硫醇。而直接水解途径的分子生物学研究尚无报道。
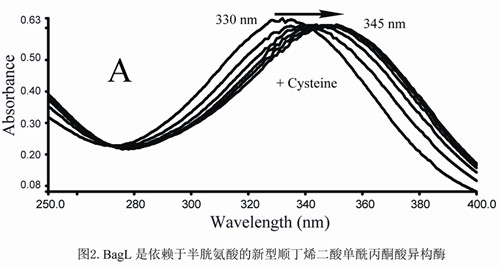
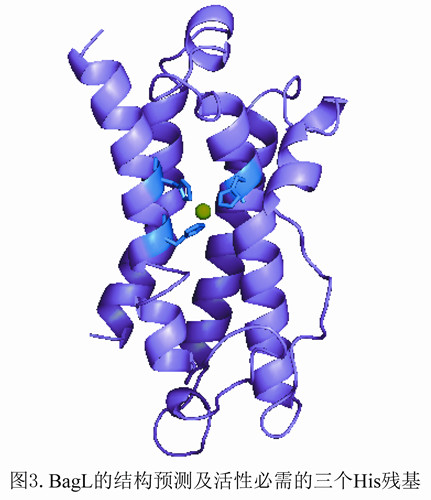
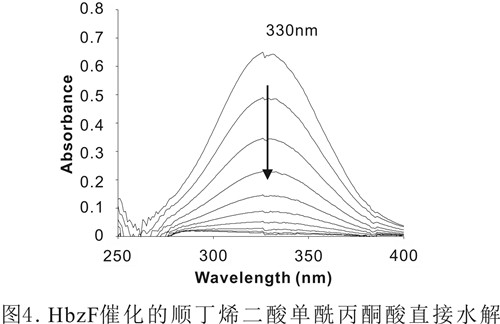
该课题组从武汉病毒所园区土壤中筛选到了含有龙胆酸降解途径的低G+C含量类芽胞杆菌NyZ101,发现并鉴定了一种新型依赖于半胱氨酸的顺丁烯二酸单酰丙酮酸异构酶,该酶利用半胱氨酸作为辅因子(图2)。该酶活性状态为同型二聚体,二价镍离子能够提高酶活性,肽链中3个保守的组氨酸构成酶的活性中心(图3)。另一研究鉴定了假单胞菌NCIMB 9867龙胆酸代谢途径中编码直接水解途径中顺丁烯二酸单酰丙酮酸水解酶的基因,该酶催化顺丁烯二酸单酰丙酮酸的水解(图4)。LC-MS检测确定该酶产物为顺丁烯二酸和丙酮酸。该酶活性状态为同型二聚体,二价锰离子能够提高酶活性。该酶与相同底物不同功能的酶进化关系较远,而与不同底物功能相似的酶(水解酶)进化关系较近。该两项研究一方面填补了龙胆酸代谢中异构途径在低G+C含量革兰氏阳性菌中的研究空白;另一方面在分子水平获得了顺丁烯二酸单酰丙酮酸直接水解途径的证据,丰富了对微生物龙胆酸代谢途径多样性的认识。
相关文章及链接
1. TT Liu and NY Zhou. 2012. Novel L-Cysteine-Dependent Maleylpyruvate Isomerase in the Gentisate Pathway of Paenibacillus sp. Strain NyZ101. J. Bacteriol.194:3987-3994; http://jb.asm.org/content/194/15/3987.abstract?sid=412e6608-4286-46b7-9248-b54845631f30
2. K Liu, TT Liu and NY Zhou. 2012. HbzF Catalyzes Direct Hydrolysis of Maleylpyruvate in the Gentisate Pathway of Pseudomonas alcaligenes NCIMB 9867. Appl. Environ. Microbiol. doi:10.1128/AEM.02931-12)。
http://aem.asm.org/content/early/2012/11/28/AEM.02931-12
(许楹、李丽萍)
 附件下载:
附件下载:
科学研究